«Geordnete» Wasserhülle um Zellen
Zucker im Ferngespräch
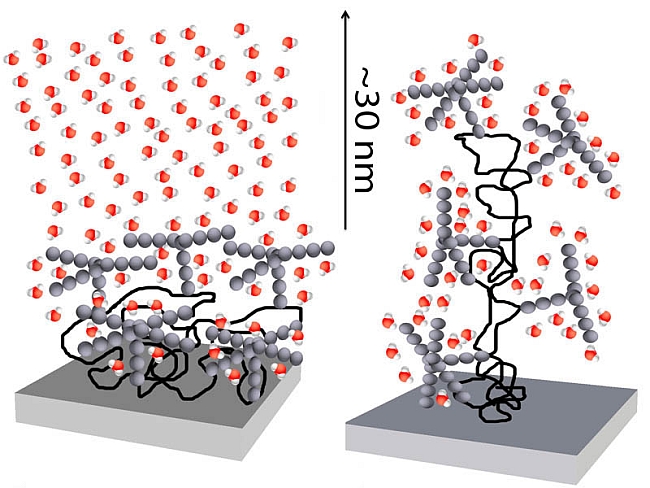
| Legende: Ein an eine Glimmerfläche angeheftetes Glykoprotein in seiner natürlichen Anordnung (links) rearrangiert Wassermolekülen (rot und weiss) über eine Distanz von etwa 30 Nanometern. Dieser Effekt verschwindet völlig, wenn die geordnete Struktur des Glykoproteins entfaltet wird (rechts; Quelle: R. Espinosa-Marzal/ETH Zürich, R. Crockett/Empa). | ||
| Glykoproteine sind ein wichtiger Teil unseres Körpers: Diese Zucker-Protein-Hybridmoleküle bilden die schützende Schleimschicht, die unsere Lungen und unseren Magen auskleiden. Sie sind Bestandteil der Flüssigkeit, die unsere Gelenke schmiert, und sie bedecken all unsere Zellen, wobei der Zuckerteil – die Glykane – wie ein Miniaturwald nach aussen ragt. Forschende der ETH Zürich und der Empa haben nun einen überraschenden Effekt von Glykanen auf sie umgebende Wassermoleküle aufgedeckt. | ||
| ETH-Forscher Nicholas Spencer und Rowena Crockett von der Empa entdeckten gemeinsam mit ihren Kollegen, dass Glykane das sonst zufällige Verbindungsnetz der Wassermoleküle ordnen. Den Effekt konnten die Forscher über mehrere Dutzend Nanometer hinweg feststellen. Diese Distanz ist enorm, verglichen mit den nur etwa 0,3 Nanometern grossen Wassermolekülen, und liegt weit jenseits aller erwarteter Grenzwerte. «Da die Membranen unserer Zellen mit Glykanen bedeckt sind, könnte dies ein Weg sein, auf dem sich Zellen über eine Barriere aus Wasser hinweg verständigen», vermutet Spencer. | ||
|
Fernwirkung auf Wasserstruktur Um die perfekt organisierte Form nachzuahmen, die Glykane auf Zelloberflächen annehmen, beschichtete Rosa Espinosa-Marzal, Mitarbeiterin bei Spencer, eine aus Glimmer bestehende Oberfläche mit einer einzelnen Schicht eines gut erforschten Glykoproteins. Während sich der Proteinteil an die Glimmeroberfläche anheftete, richteten sich die Zuckermoleküle in entgegengesetzter Richtung aus. Espinosa-Marzal rückte schrittweise eine nackte Glimmerfläche an die Glykoprotein-beschichtete heran, wobei sich zwischen beiden Flächen Wasser befand. Dabei mass sie die ständig zunehmende Abstossungskraft. «Erstaunlicherweise stellten wir Sprünge in der kontinuierlichen Zunahme der Abstossungskraft fest», erklärt Espinosa-Marzal, «so als ob wir ganze Schichten aus Wasserteilchen auf einmal herauspressen würden und der Druck dadurch für einen Moment nachlassen würde.» |
||
| Diese Sprünge werden dadurch verursacht, dass die Glykane das Netzwerk der Wassermoleküle zu Clustern oder Schichten rearrangieren. Dieser ordnende Effekt verschwand völlig, als die Forscher mithilfe einer Chemikalie die Glykoproteine entfalteten. Die Orientierung der Glykane ist somit ausschlaggebend für den ordnenden Effekt auf die Wasserteilchen über ihnen. | ||
|
Diese spezielle Wechselwirkung der Glykane mit Wasser könnte erklären, warum Glykoproteine in der Gelenkflüssigkeit unsere Gelenke so wirkungsvoll schmieren. Ausserdem erkennen etwa das Immunsystem oder Rezeptoren auf anderer Zellen den Mantel aus Zuckermolekülen, der unsere Zellen – aber auch Bakterien und Pilze – umgibt. Durch ihre Wasser-ordnende Wirkung produzieren Glykane möglicherweise einen Schutzschirm um sich herum, der beeinflusst, wie gut ein Rezeptor sie erkennen kann. Es bleibt zu klären, ob Zellen tatsächlich über eine Barriere aus Wasser hinweg mithilfe ihres Glykanmantels kommunizieren. Wahrscheinlich ist aber, dass Glykane zumindest beeinflussen, wie zwei Zellen einander wahrnehmen.
|
||
|
|||
|
|||
|
|||
